Buch 1 Beispiele
VBA Editor:
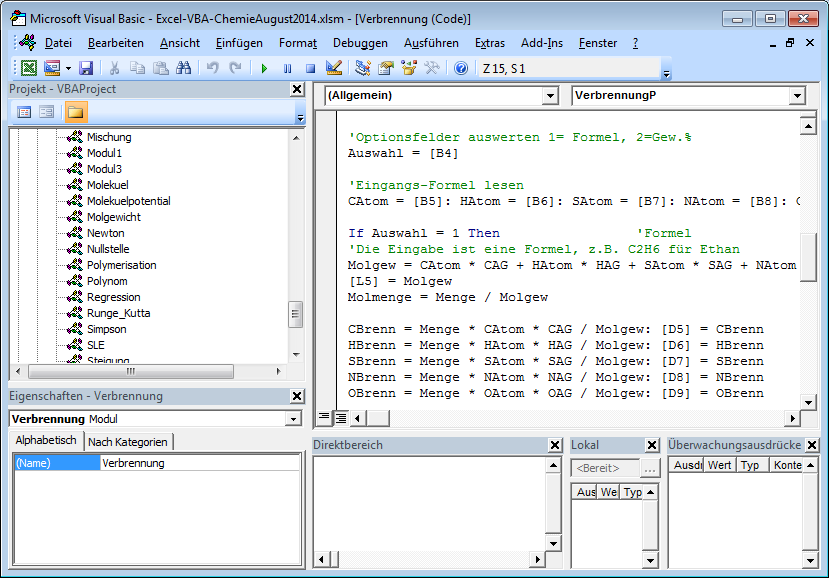
Beispiel Verbrennung
Einführung:
Funktionen in Excel und VBA, Makros aufnehmen und bearbeiten, Daten in Tabellen und in VBA verbinden, Eigene Programme schreiben, Berechnungen in eigener Benutzeroberfläche ausführen, Menüs programmieren, Spezielle grafische Darstellungen, 2-D und 3-D Grafik, Dreiecksdiagramme.
Mathematische Methoden:
Funktionen und deren grafische Darstellung, Steigung einer Funktion, Minimum einer Funktion, Lösen von Gleichungen, die Gauß-Jordan und Matrix Methode, Numerische Integration nach Simpson, Numerische Lösung von Differentialgleichungen nach Runge-Kutta, Nullstellensuche nach dem Halbschrittverfahren und Regula-Falsi, Regression von Daten.
Chemie und Verfahrenstechnik:
Maßeinheiten und deren Umrechnung, Molgewicht eines Moleküls aus der Summenformel, Reale Gasgleichung, Kompression und Expansion eines Gases, Molekularpotentiale nach Coulomb und Lennard Jones, Herstellen von Mischungen aus Reinstoffen und Gemischen, Gleichgewichtsreaktion (Gibbs, van't Hoff), Kinetische Reaktion (Arrhenius), Batchreaktoren, Rohrreaktoren, Kaskadereaktoren (Müller-Erlwein), Verbrennungsrechnung, Polymerisation (Poisson u.a.), Brennstoffzelle, stationärer und instationärer Wärme- und Stoffaustausch, Dampf-Flüssiggleichgewicht, McCabe-Thiele-Diagramm, Fest-Flüssiggleichgewicht (Gmehling), Löslichkeitsdiagramm, Füllhöhe von Behältern, Batchdestillation (Rayleigh, Schlünder), Virialkoeffizient nach Lennard Jones (Mie), Dynamische Molekülsimulation (Hamilton), Energieberechnung von Flüssigkeiten und Feststoffen (Moelwyn-Hughes, Lennard-Jones), Sprühturm-Gaswäscher, Adsorptionssäule.
Beispiel Phasengleichgewichte:
1. Ideales Phasengleichgewicht
 Datei "Ableitung-Aktivitätskoeffizient.pdf"
Datei "Ableitung-Aktivitätskoeffizient.pdf"
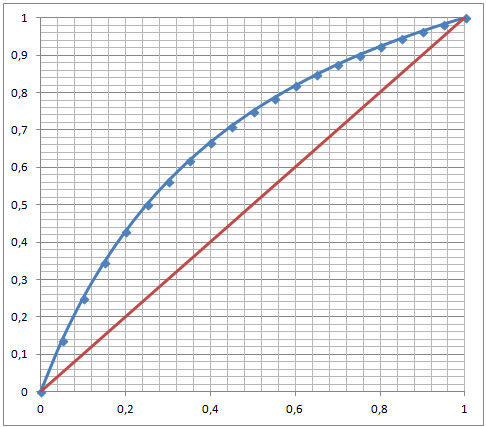
McCabeThiele Diagramm eines idelaen Zweistoffgemisches
Die Berechung erfolgt auf der Basis der Gleichung:
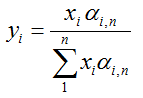
MIt dieser Berechnung lassen sich ideale Mehrstoffgemische berechnen.
2. Flüssig-Flüssig Phasengleichgewicht
Für den Aktivitätskoeffizienten gilt nach Porter:

Für das Dampf-Flüssig-Gleichgewicht (VLE) gilt das Raoultsche Gesetz:
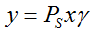
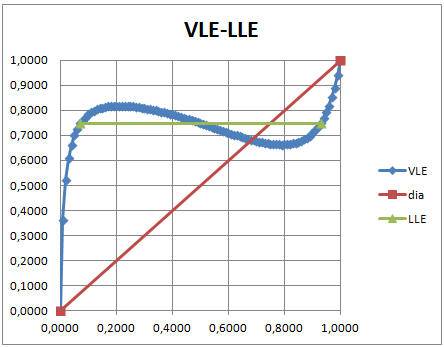
xy-Diagramm eines 2-Stoffgemisches mit heterogenem Azeotrop
Das Diagramm zeigt das Dampf-Flüssig-Phasengleichgewicht (VLE) eines binären Gemisches mit heterogenem Azeotrop. Die Horizontale kennzeichnet das Flüssig-Flüssig-Gleichgewicht und damit die Entmischung.
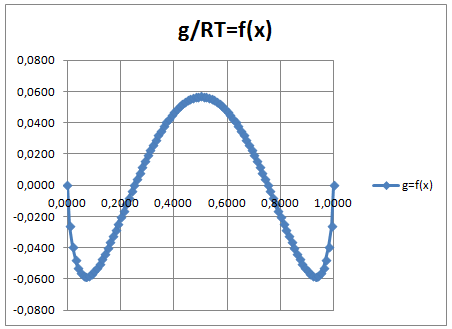
Excess Energie als Funktion der Konzentration
Das Diagramm zeigt die Excess-Energie g/RT als Funktion der Konzentration eines 2-Stoffgemisches und gibt den Verlauf der Excess-Energie als Funktion der Konzentration x wieder. Daraus ergibt sich das Flüssig-Flüssig-Gleichgewicht. Parameter sind die Flüchtigkeit und der Porter-Koeffizient. Das Porter Modell ist das einfachste Gamma-Modell im Vergleich zum besten aller Modelle, dem NRTL-Modell. Das Porter Modell benötigt nur einen Koeffizient und liefert daher nur symetrische Ergebnisse.
Die Berechnung erfolgt in Excel, ohne VBA.
Mit diesem Programm lassen sich für ein Zweistoffgemisch azeotrope Phasengleichgewichte binärer Gemische berechnen.
3. Fest-Flüssig Phasengleichgewicht
Das Programm berechnet das Fest-Flüssig-Phasengleichgewicht (SLE- Schmelzdiagramm) eines idealen Zweistoffgemisches.
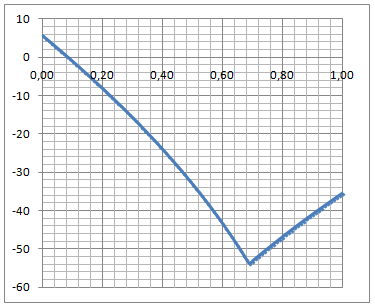
Schmelzdiagramm Dichlorethan-Benzol
Das Diagramm zeigt das eutektische Schmelzdiagramm des Gemisches 1,2-Dichlorethan-Benzol, berechnet nach der Gleichung:
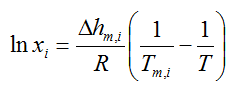
Das hier gezeigte Eutektikum ergibt sich nicht etwa aus dem realen Schmelzverhalten, sondern aus der Überkreuzung der Schmelzlinien.
Beispiel Batchdestillation
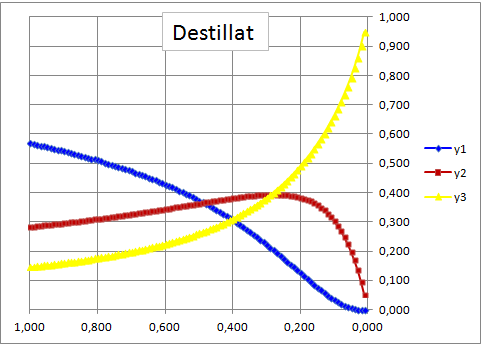
Destillatkonzentration eines Dreistoffgemisches als Funktion der Blasenmenge
Die Berechung erfolgt auf der Rayleigh-Gleichung
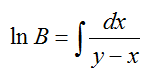
deren Lösung lautet:
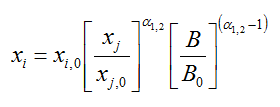
Diese Gleichung beschreibt die Bilanz einer Blase während der Destillation, sog. "Offene Destillation", d.h. ohne Kolonne. Jedoch kann diese näherungsweise nach dem Fenske Modell mit den Flüchtigkeiten verknüpft werden. Die Berechnung ist in VBA programmiert.
Kurzdokumentation: Excel-VBA in der Chemie und VT 31.03.2014
