Buch 3
A Das Lennard-Jones-Modell und dessen Anwendung
1 Einführung
Selbst wenn man die genaueste Formel zur Berechnung von Molekülen hätte (z.B. 3d-Schrödinger), wäre eine praktische Anwendung zu langsam.
Die im VDI-Wärmeatlas aufgeführten tabellierten Stoffdaten entstammen zwar Meßwerten, ihre praktische Anwendung ist jedoch ebenfalls zu langsam.
Besser sind Daten in programmierter und leicht zugänglicher Form wie z.B. die Formeln der DIPPR Gesellschaft, welche in CHEMCAD enthalten sind.
Mit der Lennard-Jones Gleichung lassen sich mit guter Näherung die Energiepotentiale zweier kugelförmiger Moleküle berechnen. Mit Hilfe der Summationskonstanten lassen sich die binären Potentiale auf ein Mol erweitern und z. B. die Bindungsenergie (s. 4.4) eines Stoffes berechnen. Siehe dazu auch Kap. 4.2.
Weitere Modelle sind Mie, Morse [Moelwyn-Hughes] und Buckingham [Fleischhauer: Excel in Naturwissenschaft und Technik], s. Anhang.
2 Literatur
a) Chemcad Prozeß-Simulation (DIPPR Stoffdaten)
b) VDI Wärmeatlas (Stoffdaten)
c) Moelwyn-Hughes: Physikalische Chemie (M.H., S. 165, 168, 174, 206, 292, 245)
d) Lüdecke: Thermodynamik (SRK: S.307)
e) Poling, Prausnitz: The Physical Properties of Gases and Liquids (S. 9.7, 11.6, B.1)
f) Christen: Grundlagen der allgemeinen und anorganischen Chemie (S. 25, 65)
g) D'Ans Lax, Band 2 und 3 (Brechungsindex)
h) Ebert, Ederer (S. 100, 110)
i) Organicum (Brechungsindex)
3 Lennard-Jones Geichungen
Bekannt sind 2 Formen der Lennard-Jones Gleichung:
a) die Gleichung von Mie
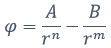
darin ist A der Abstoßungskoeffizient und B der Anziehungskoeffizient mit n = 12, m = 6.
b) die allgemein verwendete Gleichung
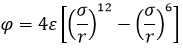
A, B, n, m, σ [Å] und ɛ aus ɛ/k [K] mit k, der Boltzmann Konstante sind Stoffkonstanten, r ist der Abstand beider Moleküle [Å]. φ ist das Energiepotenzial in den Einheiten von ɛ, d.h. J oder erg. Der Exponent m = 6 lässt sich nach Coulomb herleiten (Moelwyn-Hughes), der Exponent n = 12 ist empirisch. Die Koeffizienten σ [Å] und ɛ als ɛ/k [K] findet man u.a. in Poling, Prausnitz, sie lassen sich aber auch berechnen, wie nachstehend beschrieben ist.. σ ist der Abstand für φ = 0.
Der Zusammenhang zwischen den Gleichungen 3a) und 3b) lasst sich mit folgenden Gleichungen beschreiben:
c) ![]()
d) ![]() damit berechnet man ε
damit berechnet man ε
e) ![]()
f) 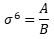
g)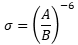 damit berechnet man σ
damit berechnet man σ
h) .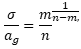 damit berechnet man ag
damit berechnet man ag
ag ist der Gleichgewichtsabstand.
Lennard-Jones Koeffizienten in Excel
Einfache Mischungsregel
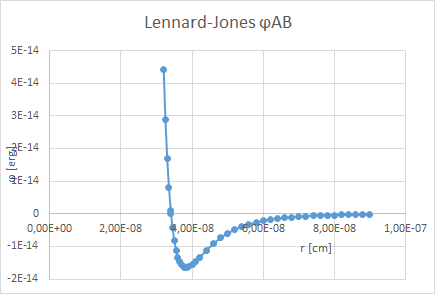
Abb. 3b Lennard-Jones Potentialkurve
Bei φ = 0 wird r = σ. Bei φ = Minimum besteht Gleichgewicht
4 Lennard-Jones Koeffizienten
Argon: ɛ/kb = 93,3 K , σ = 3,542 Å {Lit.: 2e: S. B.1 }, A = 162E-105 [erg. cm12], B = 103,4E-60 [erg. cm6], {Lit.: 2c: S. 174}. ɛ = 1,288145517E-21 erg
Mit der oben gezeigten Methode erhalten wir aus A und B σ = 3,4908E-08 und ε = 1,6499E-18 erg
kb = 1,380 649E-23 J/K = 1,380 649E-16 erg/K (Boltzmannkonstante)
1 Å = 10-8 cm
ɛ0 = 8,854 187 8128E-12 As/(Vm)
4.1 Virialkoeffizient B
Eine neue Methode besteht darin, die Lennard-Jones Koeffizienten aus der SRK- Gleichung (Soave Redlich Kwong) mit Hilfe des zweiten Virialkoeffizienten B zu berechnen.
a) Rayleigh-Gleichung aus Moelwyn-Hughes S. 45 und Ebert, Ederer S. 110 zur Berechnung des 2. Virialkoeffizienten B auf der Basis der zwischenmolekularen Wechselwirkung φ.
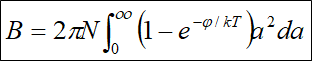
a = Molekülabstand, N = Avogadrozahl, k = Boltzmann Konstante.
und als neue Zustandsgleichung
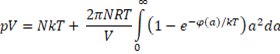
mit pV = p(V-b) und b, dem Eigenvolumen, erhält man eine Gleichung, die der van der Waals, PR, RK und SRK (Soave Redlich Kwong) Gleichung ähnlich ist, aber nicht empirisch, sondern analytisch hergeleitet ist.
Für φ wird in die Rayleigh Gleichung die Lennard-Jones Gleichung 3a eingesetzt. Die Integration erfolgt in VBA numerisch nach Simpson.
Rayleigh-Gleichung in Excel
b) B aus Zustandsgleichng SRK (Soave Redlich Kwong)
Z = 1 + B/V führt zu B = V(Z-1)
mit V = 22,71 l/mol bei 1 bar statt 1 atm
c) Vergleich beider Virialkoeffizienten a) und b)
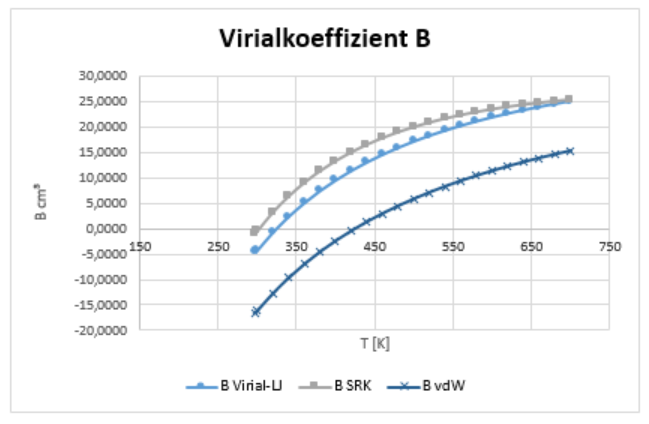
Abb. 4.1c Virialkoeffizienten für Stickstoff N2 als Temperaturfunktion nach SRK (oben), Rayleigh (Mitte) und van der Waals (unten)
In der Virialgleichung nach Rayleigh wurden die Lennard-Jones Daten mit σ = 3,698 Å und ɛ/k = 95,05 K aus Ebert, Ederer, S. 113 verwendet.
d) Anpassung
Mit Hilfe der Excel Solver Funktion werden die Koeffizienten σ und ɛ solange verändert, bis B der Rayleigh-Gleichung mit B der SRK-Gleichung übereinstimmt.
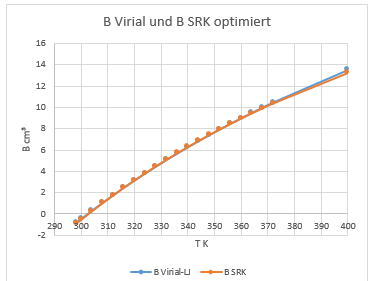
Abb. 4.1d B für Rayleigh und SRK identisch
Damit erhält man für N2 σ = 3,83 [Å] und ɛ/k 88;61 [K]. Die Daten in Poling, Prausnitz lauten σ = 3,69 [Å] und ɛ/k 71,4 [K].
e) Vergleich mehrerer kleiner Moleküle
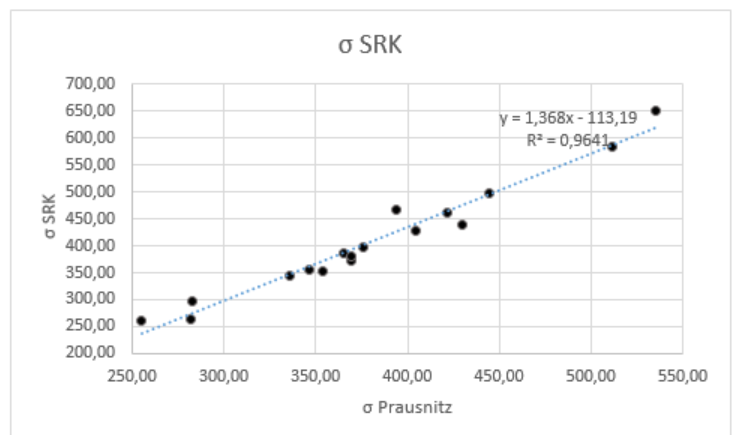
Abb. 4.1e-1 Vergleich σ Poling, Prausnitz mit σ SRK
Genauigkeit = 96,41%
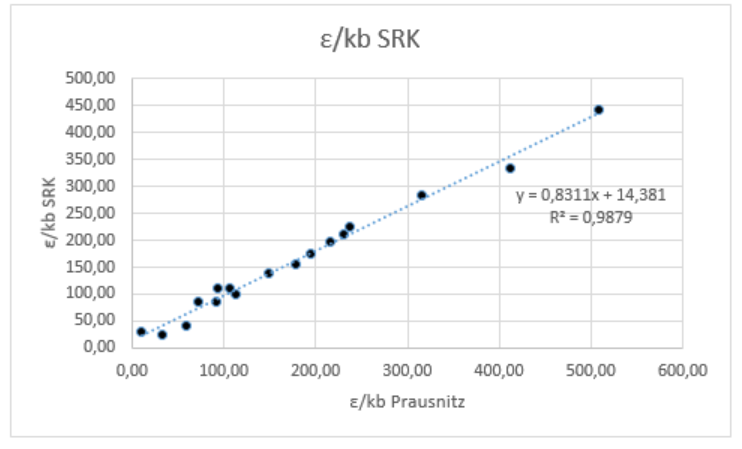
4.1e-2 Vergleich ɛ/k Poling, Prausnitz mit ɛ/k SRK
Genauigkeit = 98,79 %
4.2 Lennard-Jones Koeffizient B in Gleichung 3a
In der nachstehenden Form der Lennard-Jones Gleichung 3a
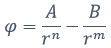
lässt sich der zweite Term nach Moelwyn-Hughes S. 245 aus 3 Beziehungen berechnen. Diese sind die Dispersion, die Orintierung und die Induktion. Der Vorteil besteht u.a. darin, dass das Dipolmoment berücksichtigt wird, ansonsten aber wird nur die Molrefraktion benötigt, s. Moelwyn-Hughes S. 205. Letztere lässt sich aus Inkrementen bzw. dem Brechungsindex berechnen.
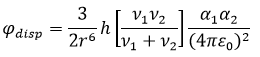
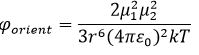
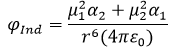
Darin sind α die Polarisierbarkeit [m³], ν die Bindungsfrequenz [s-1] und µ das Dipolmoment [Cm] mit dem Planckschen Wirkungsquantum h, der Boltzmannkonstante k und der Dielektrizitätskonstante ε0 (elektrische Feldkonstante). Diese Daten findet man u.a. in Physikalische Konstanten
In Moelwyn-Hughes S. 206 findet man Daten für diese 3 Gleichungen für etliche Stoffe. Wie leicht zu erkennen ist, erhält man über die beiden Indizes Potentiale für unterschiedliche Stoffe wie z.B. Ethanol-Wasser.
Bei der Herleitung der Formeln wurde angenommen, dass die Moleküle frei rotieren können, was bei Gasen der Fall ist.
4.3 Lennard-Jones Koeffizienten aus kritischen Daten TK und VK
In Poling, Prausnitz S. 9.7 findet man folgende Gleichungen.
ɛ/k = TK/1,2593
σ = 0,809 (VK)1/3
Darin sind Tk, die kritische Temperatur und ɛ/k in K, σ in Å, sowie Vk, das kritische Volumen in cm³/mol
Damit erhält man für Edelgase sowie kleine, unpolare Moleküle eine gute Näherungen.
4.4 Summationskonstanten der Lennard-Jones Gleichung für Feststoffe
Die Summe aller binären Potentiale eines einzelnen Moleküls mit allen weiteren Molekülen berechnet man bei einem Kristall nach Moelwyn-Hughes mit dem Lennard-Jones Modell 3a wie folgt:
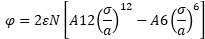
Darin sind A12 und A6 die Summationskonstanten, N ist die Avogadrozahl = 6,022 140 76E23
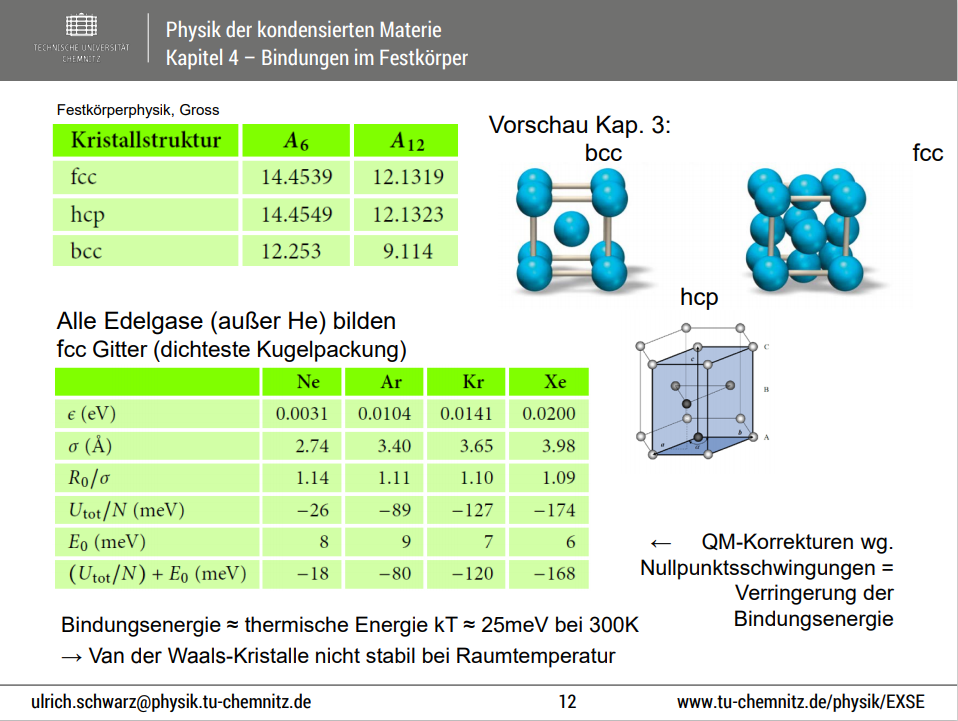
mol-1 (Teilchen pro Mol). Die Summationskonstanten hängen von der Kristallstruktur ab. Häufige Molekülstrukturen sind die kubisch einfache und hexagonale Struktur. Für kubisch einfach (sc) gilt: A6 = 8,401922 und A12 = 6,202149 (auch eigene Berechnung in Excel). Moelwyn-Hughes: A6 = 8,4018, A12 = 6,2022. Für hexagonal dichteste Packung fcc gilt A6 =14,4539 und A12 = 12,1319.
Beispiel: Bindungsenergie
Bei einer Flüssigkeit nach Moelwyn-Hughes S. 168 wird c = 6 angenommen. Alle weiteren Moleküle werden als Konzentration berechnet. Das Ergebnis ist ähnlich dem eines kubischen Kristalls.
4.5 Packungsdichte ρ
Die Packungsdichte ρ ist das Verhältnis atomares Kugelvolumen Vk / Volumen Elementarzelle Ve. Bei dem einfachen kubischen Kristall ist das Kugelvolumen Vk = 4/3·π·r3 und das Volumen Elementarzelle
Ve = (2·r)3.
Daraus erhält man die Packungsdichte ρ für das einfache kubische Kristall ρ = Vk/Ve = π/6 = 0,52360. Für die hexagonal dichteste Packung gilt ρ = √2·π/6 = 0,740480
Packungsdichte: Packungsdichte (Kristallographie) – Wikipedia (de.wikipedia.org/wiki/Packungsdichte_(Kristallographie))
B Wasserstoff Molekül aus 2 Wasserstoffatomen
1 Einführung
Aus den Potentialen der Protonen und Elektronen zweier Wasserstoffatome erhält man eine Potentialfunktion, deren Lösung zu den Daten eines H2 Moleküls führen. [Christen, Schumacher]
2 Literatur
a Christen: Grundlagen der allgemeinen und anorganischen Chemie
b Schumacher: kimb9
c) Tipler: Physik
3 Kugelwolkenpotentiale
In eine homogen geladenen Kugel mit dem Radius 1,5 a0 wird ein Proton aus dem Unendlichen bis zur Kugelmitte eingeführt, Darin ist a0 der Radius eines Atoms.
Die Gleichung dazu lautet nach Tipler S. 904 und nach Schumacher S. 8
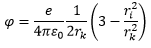
Darin ist ri der Abstand des Protons vom Kugelmittelpunkt und rk der Kugelradius .
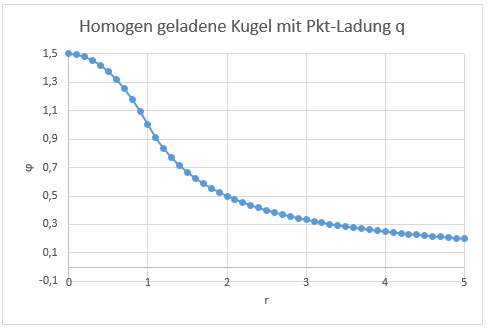
Abb. B3.1 Potenzial einer Punktladung (Proton) mit einer homogen geladenen kugelförmigen Elektronenwolke Radius R = 1,5 a0
Überlappungspotential zweier homogen geladener Kugelwolken mit dem Radius a0.
Schumacher S. 23ff
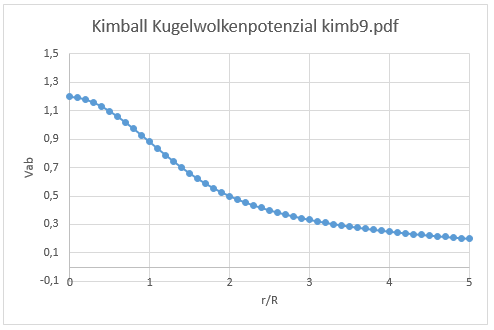
Abb B3.2 Überlappungs-Potenzial zweier homogen geladener kugelförmigen Elektronenwolken nach Kimball
Ist r = 0, lautet das Potenzial φ = 1,2. Diesen Wert erhält man auch, wenn man die totale Überlappung direkt berechnet, Schumacher S. 10-11
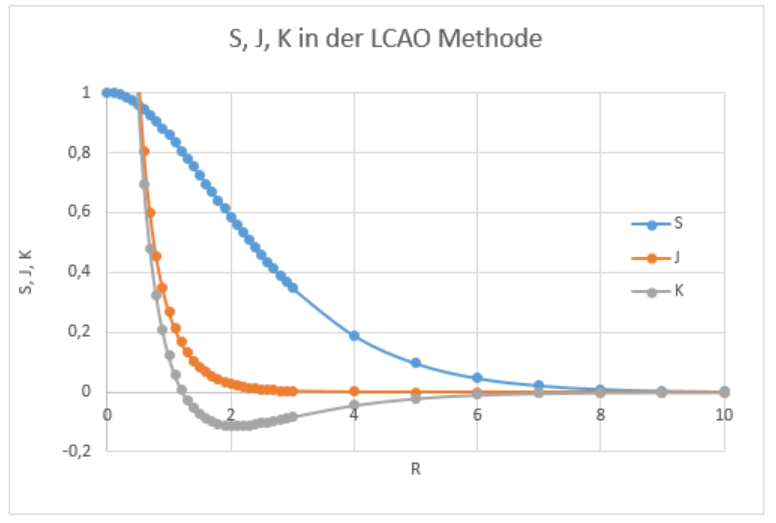
Abb. B3.3 Überlappungs-Potenziale der LCAO Methode (Herleitung nach TU Braunschweig Prof. Dr. Gericke)
4 Kimball
Kimball entwickelte mit der Coulombschen Energiegleichung einer homogen geladenen Kugel ein sehr einfaches und doch genaues Modell zur Berechnung der Wasserstoff-Atom Potenziale. Damit lässt sich sogar die Bildung eines Wasserstoffmoleküls H2 berechnen (Christen).
Kimball und Schumacher S. 12
C Anhang
1 Buckingham Potenzial
Die Buckingham Gleichung ist der Lennard-Jones Gleichung ähnlich. Die Buckingham Gleichung erlaubt die Berechnung atomarer Potenziale z.B. H-H, C-C und C-H.
Literatur: Fleischhauer: Excel in Naturwissenschaft und Technik.
Artikel: Buckingham Potenzial
2 Beispiel: Wasser als 3D Modell
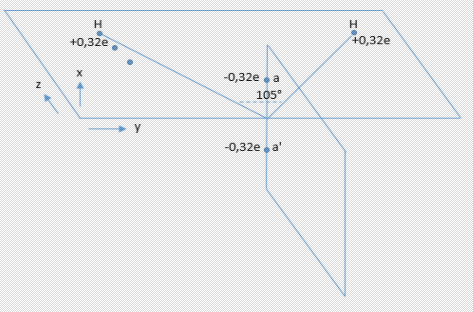
Abb. C2 Ladungsschwerpunkte von Wasser nach Rowlinson (Moelwyn-Hughes S. 263). Gemeinsam mit den Potenzialen der Protonen lassen sich leicht Coulomb Potenziale und van der Waals' sche Potenziale beliebiger Moleküle berechnen.
3 Atomare Daten s. Start
4 Sonstiges
Problem: Alle Eigenschaften von Molekülen lassen sich auf zwischenmolekulare Wechselwirkungen, sog. van der Waals-Potenziale zurückführen. Leider findet man dazu in der Literatur viel zu wenig. In der Praxis werden meist halbempirische Funktionen verwendet. Dies ist vermutlich darauf zurückzuführen, dass die Berechnungen sehr aufwendig und ohne entsprechende Programmierung nicht möglich sind. Das coulombsche Potenzial zweier Atome setzt sich z.B. aus den Potenzialen Proton1-Proton2, Elektron1-Elektron2, Proton1-Elektron2 und -Proton2-Elektron1 in Abhängigkeit von r, dem Abstand Proton1-Proton2 von 0 bis unendlich zusammen. Davon sind die Potenziale der Protonen einfach zu berechnen, da es sich um Punktladungen handelt. Problematisch sind die Potenziale der Elektronen, da diese keine Punktladungen sind. Es gilt, dieses Phänomen exakt zu beschrieben. Molekül- und Atompotenziale lassen sich nach Buckingham, Lennard-Jones, Mie und Morse beschreiben.
Dipolmomente: https://www.zum.de/Faecher/Materialien/beck/chemkurs/cs11-15.htm
https://www.amazon.com/Physikalische-Simulationen-mit-Personalcomputer-Quantenmechanik/dp/3662093332
Im hexagonalen hcp Kristall ist die Elementarzelle ein Tetraeder. Ebenso bilden viele Kohlenstoffverbindungen wie z.B. CH4 einen Tetraeder. Die Höhe h einer Tetraederfläche beträgt h = 0,5*wurzel(3) = 0,866025404, die Höhe des Tetraeders ist H = wurzel(2/3) = 0,816496581. Der Winkel des C-Atoms zu je 2 H-Atomen beträgt arccos(-1/3) = 109,47122064491
