AtomOrbitale
Die Wellenfunktion des Wasserstoffs nach Schrödinger und die Aufenthaltswahrscheinlichkeit des Elektrons.
Quelle: Hydrogen Ground State (hyperphysics.phy-astr.gsu.edu/hbase/quantum/hydr.html)

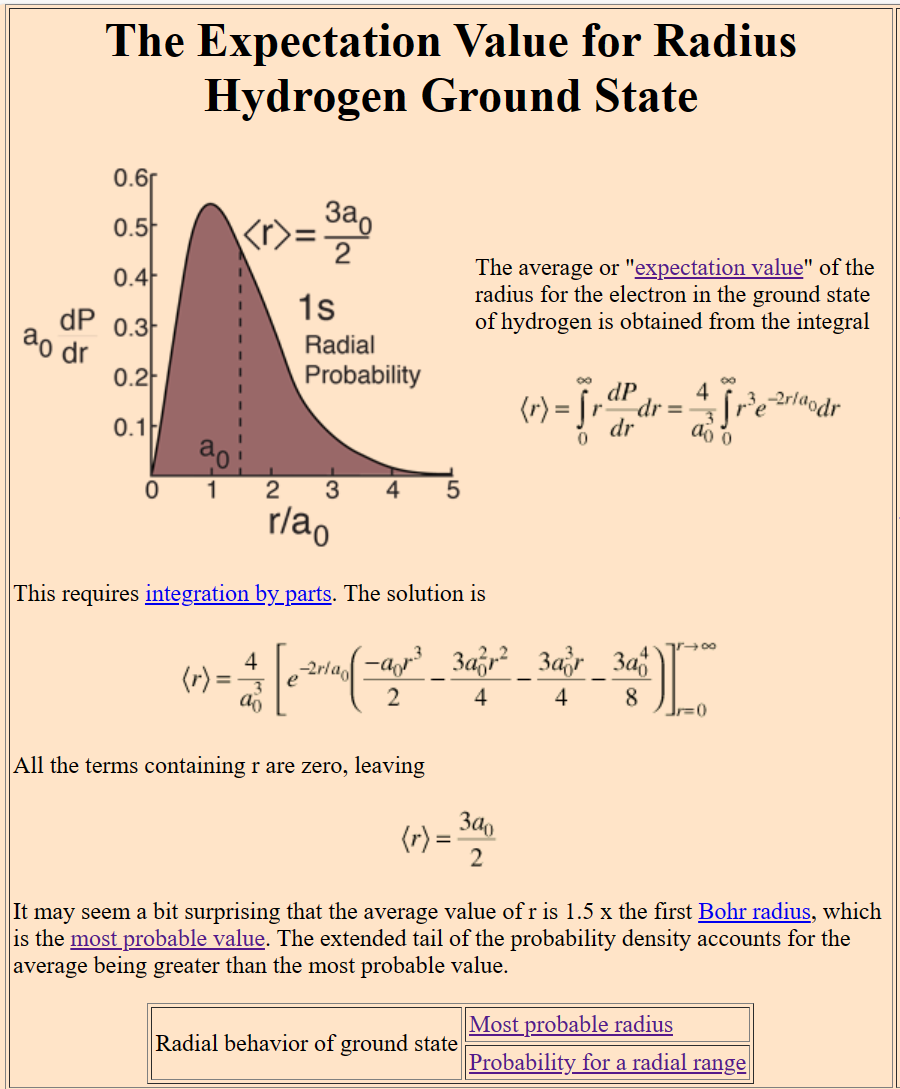
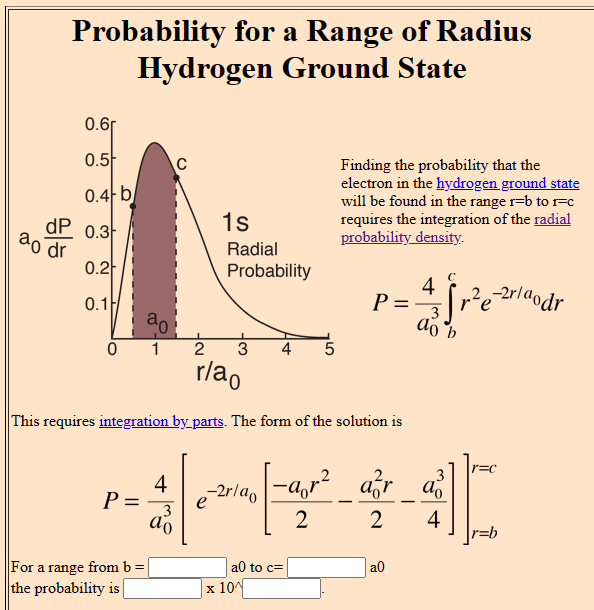
Eigene Berechnungen in Excel
Bei der Bildung eines H2 Moleküls überlappen sich die Elektronenorbitale beider H-Atome. Kimball hat dies berechnet, indem er als Näherung das Elektronenorbital durch eine homogene Kugel ersetzt hat mit r = 1,5 a0. Gerricke (TU Braunschweig) hat im Rahmen des LCAO Modells die Orbitalüberlappung analytisch hergeleitet.
Die Wellenfunktion nach Schrödinger lässt sich in Excel wie folgt darstellen
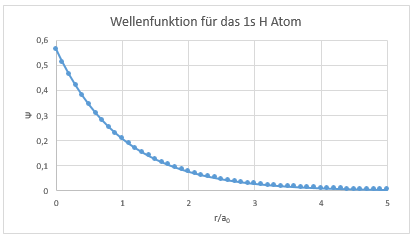
Die Schrödinger Wellenfunktion eines 1s H-Atoms
Aus dem Quadrat dieser Wellenfunktion erhält man die Aufenthaltswahrscheinlichkeit (Elektronendichte). Diese lässt sich für das 1s Orbital eines H-Atoms in Excel wie folgt darstellen:
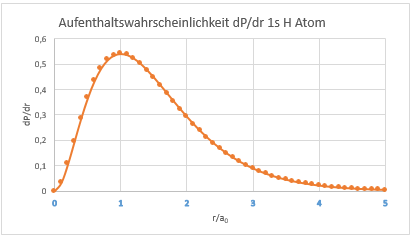
Aufenthaltswahrscheinlichkeit eines 1s Elektrons im H-Atom nach Schrödinger
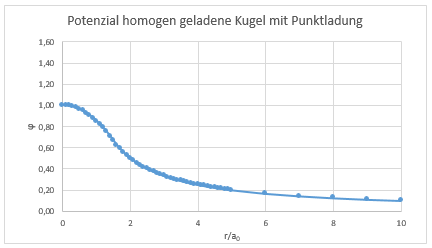
Potenzial einer Punktladung (Proton bzw. Elektron) in einer homogen geladenen Kugelwolke (s. Tipler 6. Aufl. S. 904)
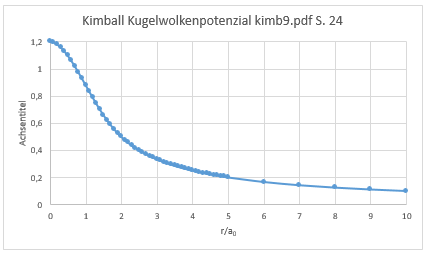
Potenzial zweier homogener Kugelwolken nach Kimball und Schumacher
Das Potenzial zweier 1s Orbitale erscheint in kürze.
